Diese Übungsaufgabe entspricht dem in der Stunde besprochenen Beispiel:
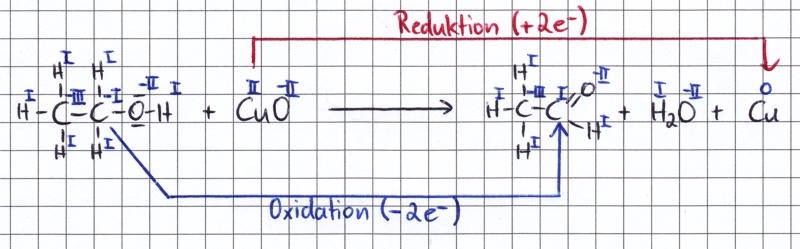
| Beim Aufstellen der
Elektronenbilanzen werden Oxidations- und
Reduktionsreaktion jeweils getrennt betrachtet. Dir ist die
Schreibweise wahrscheinlich aus der 9. Klasse bekannt. Ethanol wird zu Ethanal oxidiert, dabei werden 2 Elektronen, sowie zwei Protonen abgegeben. Das Kupferoxid wird durch Aufnahme von 2 Elektronen zum elementarem Kupfer reduziert. Genauer gesagt wird nur das Kupferion reduziert, das Oxidion bleibt erhalten - es aufgrund seiner Reaktivität als freies Ion nicht existent und wird daher in Klammern "< >" gesetzt. Mit den bei der Oxidationsreaktion freiwerdenden Protonen (H+-Ion) reagiert es letztlich zu Wasser. Schließlich ist noch die Gesamtredoxgleichung dargestellt. Um sie aufzustellen, zählt man jeweils alle Reaktionspartner links der Reaktionspfeile bzw. rechts der Reaktionspfeile zusammen. Die Elektronen werden bei diesem Schritt bereits "herausgekürzt". In unserem Beispiel werden bei der Oxidation 2 Elektronen frei, bei der Reduktion werden 2 Elektronen benötigt. In diesem einfachen Fall können die Elektronen daher ohne Probleme "verrechnet" werden. |
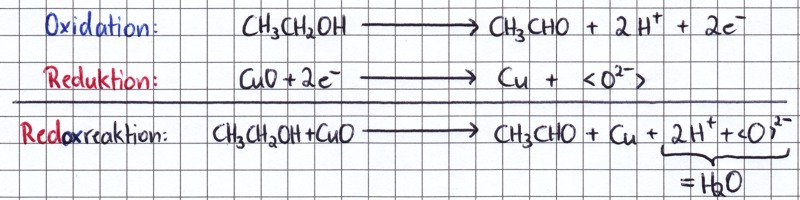
| Zu guter letzt noch etwas zur Schreibweise. In den obenstehenden Gleichungen wurde die "Halbstrukturformel" verwendet. Die Formel CH3CH2OH lässt zweifelsfrei erkennen, dass es sich bei diesem Stoff um einen Alkohol handelt, da die charakteristische Hydroxylgruppe in der Formel erkennbar ist. Würde hingegen die reine Summenformel (C2H6O) verwendet, könnte es sich hierbei sowohl um Ethanol, als auch um Dimethylether handeln. Im Vergleich zu "richtigen" Strukturformeln ist die Halbstrukturformelschreibweise jedoch deutlich bequemer und platzsparender. Aldehyde bzw. Alkanale werden bei Halbstrukturformeln durch die "CHO" Gruppe gekennzeichnet. |